2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
发布日期:2023-07-03
浏览次数:62
7月2日,博锐生物首款创新药泽贝妥单抗(商品名:安瑞昔®)商业上市会在上海举行。该产品适用于联合标准CHOP化疗治疗CD20阳性弥漫性大B细胞淋巴瘤(DLBCL)。安瑞昔®的上市不仅是博锐生物肿瘤免疫管线布局开发的重要里程碑,也标志着博锐生物完成从生物类似药到生物创新药的蜕变。

DLBCL是非霍奇金淋巴瘤中最常见的亚型,临床治疗需求强劲。目前临床上经典的一线药物是获批26年之久的美罗华®(利妥昔单抗),安瑞昔®作为DLBCL临床治疗的新选择,对标的正是这位“老大哥”。
泽贝妥单抗相比利妥昔单抗有何特别之处?从生物类似药企业发展到创新药企业,博锐生物做了哪些准备?未来还会有哪些布局?借安瑞昔®商业首发之际,医药魔方近日采访了博锐生物首席执行官(CEO)王海彬博士和首席医学官(CMO)朱伟博士。

王海彬博士,浙江博锐生物制药有限公司CEO
从事微生物和生物制药领域研究与开发工作近30年,在该领域从早期开发到商业化生产均具有丰富经验,主导首款国产抗CD20抗体1类创新药和浙江省融合蛋白以及第1个单抗上市。作为国家药典委员会委员、正高级工程师、中国药学会生物制品委员会委员和浙江省药学会生物制药专委会副主委,积极参与WHO关于生物类似药的技术指南制定,主持并圆满完成数十项国家和省部级项目,在国内外核心刊物发表论文近40篇,拥有PCT和国内发明专利数十项。曾获化工部科技进步一等奖、国家科技进步二等奖、国家八五科技攻关重大科技成果、浙江省药学会医药科技奖、浙江省科学技术二等奖、上海市科学技术二等奖、浙江省151人才工程重点培养人员、杭州市优秀企业家等殊荣,享国务院特殊津贴。

朱伟博士,浙江博锐生物制药有限公司CMO
在全球 药企有着25年的欧美及亚太地区临床研发经验。曾任优时比(UCB)全球免疫临床研发团队负责人,其负责的管线包括希敏佳(Cimzia)和比美吉珠单抗(Bimzelx)等全球 创新产品;在UCB早期工作时曾作为优时比亚太地区临床研发及免疫学治疗领域临床研发负责人,将骨质疏松症、自身炎症性疾病和自身免疫疾病研发管线引进亚洲。在赛尔基因(Celgene)、百时美施贵宝(BMS)、诺华(Novartis)等全球知名医药企业负责多个创新药的全球临床研发项目,其中包括阿普斯特(Otezla)、阿巴西普(Orencia)和易来力(Ilaris)等免疫炎症治疗领域代表性创新药,还曾为国内多家创新企业引进了国际 的产品管线,并建立了与管线高度匹配的专业团队。
泽贝妥单抗 vs. 利妥昔单抗:青出于蓝而胜于蓝
淋巴瘤是最常见的恶性血液肿瘤,包括霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)两种类型,而DLBCL是最常见的一种NHL,约占NHL的30%~40%。据GLOBOCAN 2020统计,全球每年NHL新发病例和死亡病例分别约为54.4万例和26.0万例。《中国淋巴瘤治疗指南2021版》报告,2020年中国NHL新发病例和死亡病例分别约为9.3万例和5.4万例。
1997年获批上市的利妥昔单抗是全球首款DLBCL靶向治疗药物,此后的20多年间有13款靶向药物陆续上市,但以利妥昔单抗为基石的R-CHOP方案,在一线治疗中的地位从未被撼动。利妥昔单抗的疗效毋庸置疑,相比传统化疗,此疗法可以将DLBCL患者的完全缓解率(CRR)从30%~40%提升至50%~60%。不过,在实现完全缓解的患者中,大约30%~40%的患者会经历复发,这些患者的生存率也因此大大下降。为此,新药研发者们纷纷把目光投向了开发升级版“美罗华®”。
利妥昔单抗之后问世的CD20单抗 ,在人源化程度上大幅提高,例如奥法妥木单抗、奥瑞珠单抗和利妥昔单抗的人源化程度分别为100%、>90%和65%,研发从DLBCL拓展到了自身免疫性疾病;另外,奥妥珠单抗进一步对抗体Fc片段进行了改造,增强了抗体依赖的细胞毒作用(ADCC)效应。
已上市CD20单抗[1]
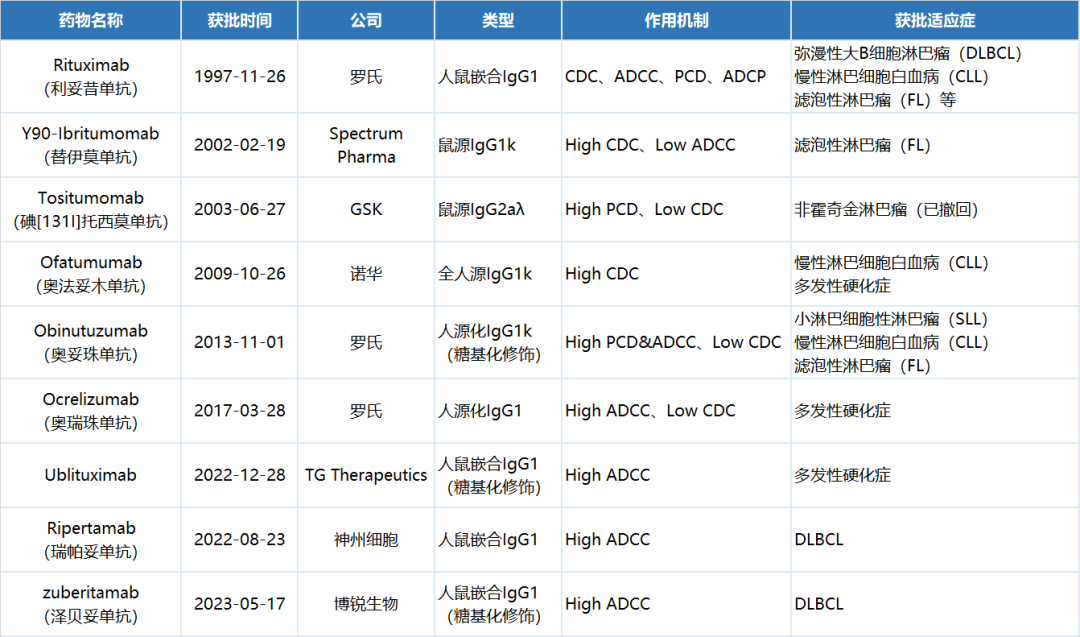
作为一款新型抗CD20单抗,泽贝妥单抗在分子设计上有不同于一代二代的地方。王海彬博士介绍称:“泽贝妥单抗是基于利妥昔单抗设计的一种新型人鼠嵌合型IgG1单抗,在抗体的互补决定区(CDR)进行了氨基酸的调整并减少抗体Fc片段的岩藻糖(Fucose)来增强它的ADCC效应。这个在临床前研究中得到了验证,泽贝妥单抗的ADCC效应相比利妥昔单抗提升了约10倍。体内药效学实验也表明,泽贝妥单抗抑制肿瘤生长的能力优于利妥昔单抗。”
朱伟博士补充道:“结构的优化还带来了一个意想不到的效果,更高的组织穿透能力。泽贝妥单抗的II期PK数据显示,其相比利妥昔单抗,具有更高的分布容积。增强的ADCC和更好的组织分布充分反映在更长效的PD和更优越的临床CR和PFS上。”
泽贝妥单抗联合CHOP(Hi-CHOP)对比利妥昔单抗联合CHOP(R-CHOP)治疗DLBCL患者的III期研究中达到了主要终点,即Hi-CHOP组和R-CHOP组在患者的客观缓解率(ORR)达到均非劣效。
对次要重点CRR和PFS的分析显示,Hi-CHOP组的CRR和PFS在各个时间段均高于R-CHOP组,并达到了统计学显著性差异。Hi-CHOP组的1年、2年、3年无进展生存率和总生存率均高于R-CHOP组。
谈到这些令人惊喜的临床数据,王海彬博士非常自豪地说:“提高DLBCL患者的PFS和OS并做出具有中国特色的创新产品是我们开发泽贝妥单抗的初衷。我们相信泽贝妥单抗会成为国内DLBCL患者的更好选择。”
泽贝妥单抗是博锐生物管线中第一款肿瘤领域创新药,其在非肿瘤中的临床应用更广。目前,博锐生物正在开展泽贝妥单抗用于治疗免疫性血小板减少症(ITP)的II期临床试验。朱伟博士透露,该II期研究目前已进入收尾阶段,盲态数据在我们预期范围内,在有效性安全性上给到我们信心,我们期待揭盲后的结果。
ITP是一种由于免疫系统异常活化而攻击自身血小板造成的一种出血性疾病,国外报道的成人ITP发病率为(2~10)/10万[2],儿童ITP发病率为(1.6~5.3)/10万[3]。目前,ITP的一线治疗方案主要是糖皮质激素和人免疫球蛋白;二线治疗方案包括TPO受体激动剂、重组人TPO、利妥昔单抗(off-label)。然而,长期应用激素会带来诸多较为严重的不良反应,安全风险较高;免疫球蛋白价格昂贵且疗效难以维持;TPO疗法则有血栓风险。可以说,ITP领域存在巨大的未被满足的临床需求。
在谈到为何选择ITP这一适应症作为泽贝妥单抗在自身免疫领域的首发适应症时,王海彬博士表示:“ITP领域的治疗需求很大,目前临床上还没有出现一款特别合适的治疗药物适用于患者。虽然利妥昔单抗在指南中被推荐为二线选择,多项研究者发起的临床试验(IIT)也证实了利妥昔单抗治疗ITP的疗效与安全性,但是它并没有正式在美国、欧盟、中国获批ITP适应症,所以现在患者是超适应症用药。这就带来一个问题,ITP患者难以通过医保报销昂贵的治疗费用。为了解决这一临床痛点,我们决定探索泽贝妥单抗在ITP上的应用。还有一个原因是,大部分患者在连续静脉滴注4次(每周1次)利妥昔单抗后即可维持6~12个月的缓解。这是TPO疗法达不到的效果,我们认为泽贝妥单抗也有这种潜力。”
朱伟博士进一步补充道:“B细胞在很多自身免疫性疾病的发病机制中起到关键作用,我们希望以ITP作为起点,研究泽贝妥在各种自免疾病中的应用,特别是为临床未满足需求提供解答方案。”
博锐生物:从CD20出发,打造自身免疫+肿瘤免疫双龙头
迄今,博锐生物在自身免疫领域已经有比较扎实的研发经验,已上市的6个品种有4个是自免领域的产品。其中,包括安佰诺(注射用重组人II型肿瘤坏死因子受体-抗体融合蛋白)、安佰特(英夫利西单抗生物类似药)、安健宁(阿达木单抗生物类似药)和安舒正(枸橼酸托法替布片)。凭借这4个单品,博锐生物已经在风湿科、皮肤科、消化科等科室深度渗透,并在国内的自免领域站稳了脚跟,甚至可以说,已经超越了大部分同类企业。
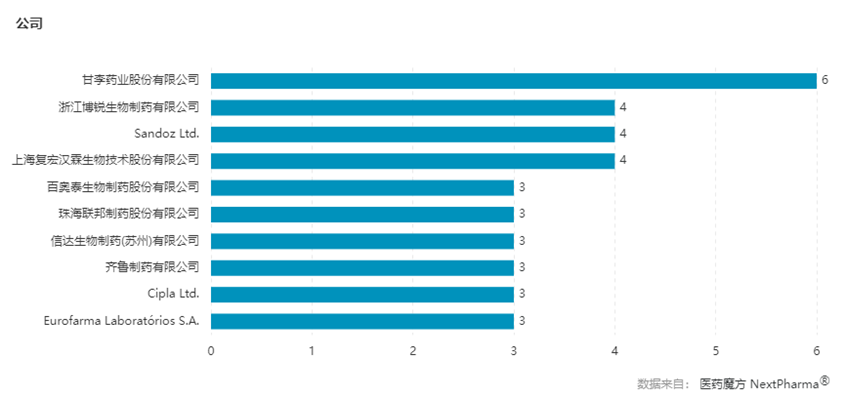
国内免疫领域已上市生物类似药所属公司统计
值得注意的是,博锐生物的野心并不止于此,而是向“自免+肿瘤免疫”双龙头迈进,从其管线布局中,我们也可看出一丝端倪。官网显示,在肿瘤免疫领域,博锐生物目前至少拥有10多款在研产品,靶点涵盖肿瘤免疫过程中的多个生物标志物,其类型也涉足了单抗、双抗、三抗和ADC等多种类型以期服务更多的患者群体。
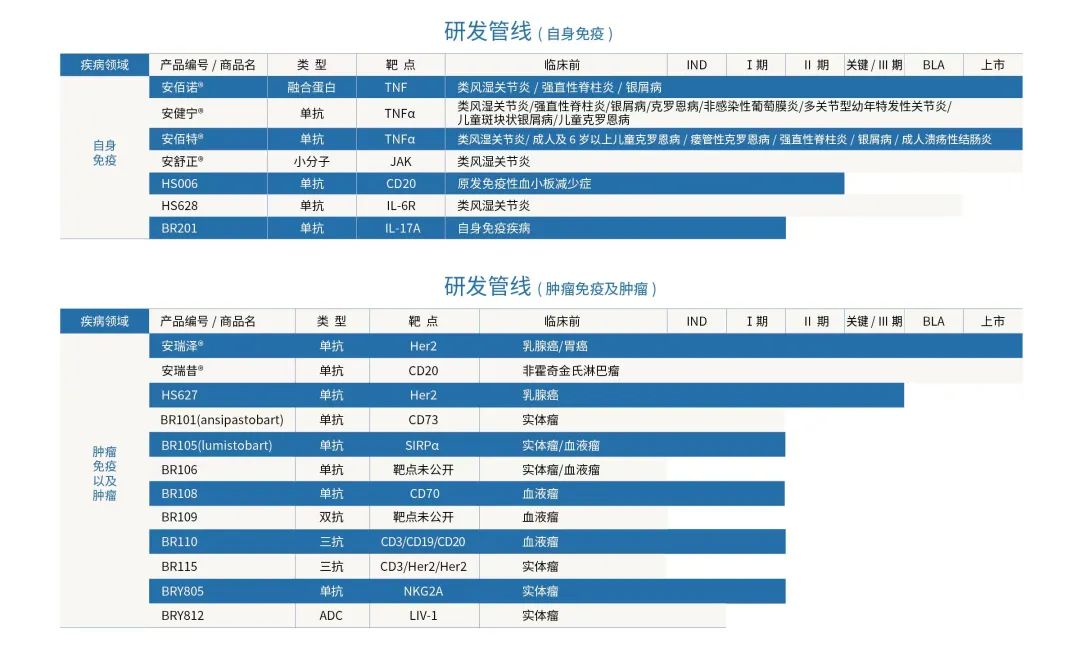
BR110(CMG1A46)是博锐生物管线中尤为值得期待的一款产品。该产品自恩沐生物引进,通过同时靶向肿瘤细胞上的CD19及CD20和T细胞表面的CD3,拉近肿瘤细胞和T细胞的空间距离,达到激活T细胞以杀伤CD19+/CD20+肿瘤细胞的效果。目前,BR110在国外已推进至I/II期临床阶段,在国内已获批开展临床。
对于这款产品,王海彬博士表示:“目前,靶蛋白表达下调是淋巴瘤耐药和复发的主要原因之一。从这个角度来说,一旦出现靶蛋白水平下调,CD19单抗、CD20单抗这种单靶点药物就很难再发挥效果了,所以开发一个CD3/CD19/CD20三抗可以更大程度避免耐药问题的出现。在美国开展的I/II期临床中,我们还发现了一件很有意思的事情,BR110对接受CAR-T疗法后产生较强耐药性或者无效的患者也有一定的治疗效果。”
BRY812是国内首款靶向LIV-1的ADC药物,全球进度仅次于默沙东的MK-6440。此外,博锐生物正在强化部署双抗ADC。
整体来看,博锐生物在肿瘤免疫的布局呈现出多平台化、差异化的特点,并且部分产品的开发进度已走在国际前列。可以观察到,博锐生物采取的是稳中求进的策略,管线分布呈阶梯结构,平衡不同研发进程和不同成功可能性,并且保持一定数量的候选药物。
稳进的开发速度背后需要研发实力的支撑。目前,博锐生物拥有浙江台州、杭州富阳、上海及美国圣地亚哥等四个研发中心,其中,上海研发中心于去年8月正式成立,负责转化医学研究。博锐生物还建立了一个博士后研发站,专注于早期开发。“总体研发团队目前有200+人,临床团队大概有100+人,早期开发、CMC和工艺开发团队有100+人。在整个研发体系里,有诸如在大型跨国药企工作过的CMO朱伟博士,深耕大分子药物研发20余年、曾任美国强生公司首席科学家的产品开发副总裁武兵元博士以及诸多国内博士后。我们期待优秀的人才能够继续留在博锐,共同创造更多有价值的产品。”王海彬博士介绍团队时说道。
在保持内部创新不断输出新产品的同时,博锐生物也在发掘自家产品出海的机会。王海彬博士表示:“我们商务拓展团队已经在跟海外公司接触了。我们希望未来可以在真正差异化创新产品的基础上,拿到更多的临床数据来支持海外市场的开拓。”
商业化提速,为创新保驾护航
如果说创新能力是一家药企能否在业界站稳脚跟的基石,那么商业化能力一定是稳固这个基石的保障。博锐生物的第一款商业化产品安健宁如今已登顶国内的阿达木单抗生物类似药。截至2022年年底,凭借3款生物类似药在自免领域的发力,博锐生物的营收已超过9亿元,其商业化能力有目共睹。
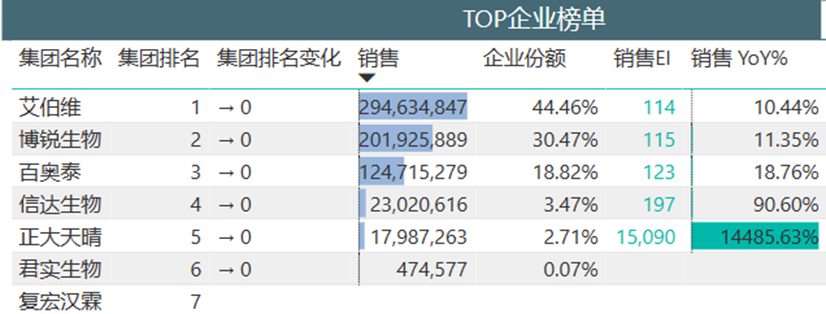
国内阿达木单抗销量情况
(来源:医药魔方PharmaBI数据库)
目前,博锐生物的商业化团队近800人,自免和肿瘤两个事业部。“我们也基于自免团队从0到1组建以及从1到10发展的经验方法论搭建了肿瘤团队。支持部门也在为泽贝妥单抗的商业化做相应准备,包括注册、生产、市场营销和市场准入等环节。不过这次的情况稍有不同,获批的是一个创新药品种,这是我们之前没做过的,所以并不能完全套用过往品种的商业化路径。”王海彬博士介绍道,“另外,我们已经请专业团队作为博锐生物的咨询顾问,协助推进医保谈判,也可以惠及更多的患者。”
在商业化产能保障方面,博锐生物凭借成熟的工艺开发和规模化的生产能力,目前已经累计生产近300批次,成品超过500万支。博锐生物目前的商业化产能达到20000L,预计未来将超过40000L+。产能的不断升级也将持续刺激博锐生物高价值产品的商业化成绩继续增长,从而反哺研发端,以期更好地驱动整体发展。
王海彬博士在采访中分享了未来她对博锐生物的希冀。“博锐是一个特别踏实的企业,它始终是依赖于技术去发展的。未来3~5年,我希望博锐可以收获第2款创新药的上市,也希望博锐成为免疫领域的旗帜,业内提到免疫的时候,就能立即联想到博锐。”
在全球,自免药物的市场规模已达千亿美元级别。若要提及全球自免头部企业,大家也会很快想到艾伯维、强生、赛诺菲等公司。但是在中国,自免领域的发展却是另一番境况,2021年自免药物市场规模仅30亿美元[4],真正意义上的龙头企业也尚未出现。
再看肿瘤免疫领域,2021年全球肿瘤免疫药物市场规模约452亿美元,而中国的市场规模约为27亿美元[5],与其相比差距仍然较大。
不管是自免领域还是肿瘤免疫领域,凭借国内庞大的患者需求,其市场潜力都值得期待。谁将 “双免”领域前进,并带来更多创新药物,各方也在跃跃欲试。从目前已上市的产品来看,博锐生物已经在中国自免领域名列前茅,同时在创新产品的加持下,博锐生物凭借泽贝妥单抗的获批及后续的持续性发力,相信其能在未来能够制造更多惊喜成果。
总结
今年,博锐生物迎来了两款重磅生物药(曲妥珠单抗生物类似药和泽贝妥单抗)的获批,为博锐生物未来走向“自身免疫+肿瘤免疫”双龙头打下了坚实的基础。随着后续三抗产品及ADC产品开发的推进,博锐生物的创新色彩和肿瘤特色也将越来越鲜明。“希望以后大家提到免疫的时候就想到博锐,我们也希望未来能够在免疫领域发挥龙头的作用,促进产业良性发展。”祝福一切如王海彬博士所言。
参考文献:
[1]The applications of anti-CD20 antibodies to treat various B cells disorders.
[2]成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)
[3]中国儿童原发性免疫性血小板减少症诊断与治疗改编指南(2021版)
[4]荃信生物招股书
[5]弗若斯特沙利文报告

回到顶部