2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
发布日期:2023-05-25
浏览次数:30
5月25日,浙江博锐生物制药有限公司(以下简称“博锐生物”)宣布,公司自主研发的BR201注射液临床试验申请获国家药品监督管理局批准。BR201注射液是博锐生物自主开发的一种靶向IL-17A的单克隆抗体,主要用于治疗银屑病和强直性脊柱炎。
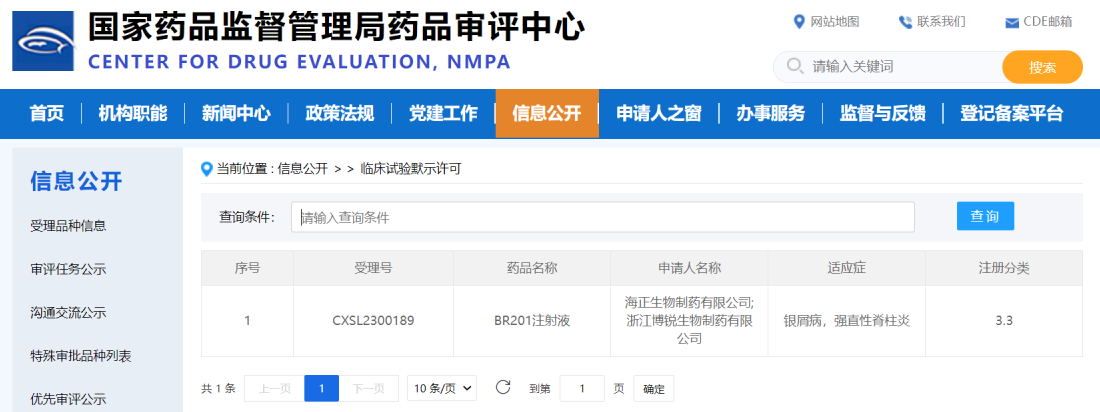
BR201注射液是诺华生产的司库奇尤单抗(商品名:可善挺®)的生物类似药。可善挺®于2015年分别在欧洲和美国上市,2019年进入中国市场。目前,中国已获批的适应症包括银屑病和强直性脊柱炎。
司库奇尤单抗可选择性结合并中和促炎细胞因子IL-17A并抑制其与IL-17受体相互作用,该受体在包括角质形成细胞和滑膜细胞在内的多种细胞类型上表达,因此司库奇尤单抗可抑制促炎细跑因子、趋化因子和组织损伤介质的释放,改善自身免疫和炎性疾病的影响。
与可善挺®全面的质量相似性、临床前药理毒理比对的研究结果显示,BR201注射液在药学、临床前药效、药代动力学和安全性等方面与可善挺®高度相似。
博锐生物CEO表示:“今年以来,继安瑞泽®(注射用曲妥珠单抗)、安瑞昔®(泽贝妥单抗注射液)获批上市,安佰欣®(托珠单抗注射液)报产申请获受理,1类新药BRY805、BR108临床试验申请获批, BRY812的临床试验申请获NMPA受理接连传来的好消息后,很高兴看到BR201也传来捷报。博锐生物聚焦免疫领域,持续深耕以探索更多创新药物和生物类似药的双轮驱动发展模式,不断提供全面且多样性的产品组合及解决方案,为患者带来更多可及性药物。期待BR201能为银屑病和强直性脊柱炎患者治疗带来便利和更多临床获益。"

回到顶部