2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
发布日期:2021-06-21
浏览次数:11
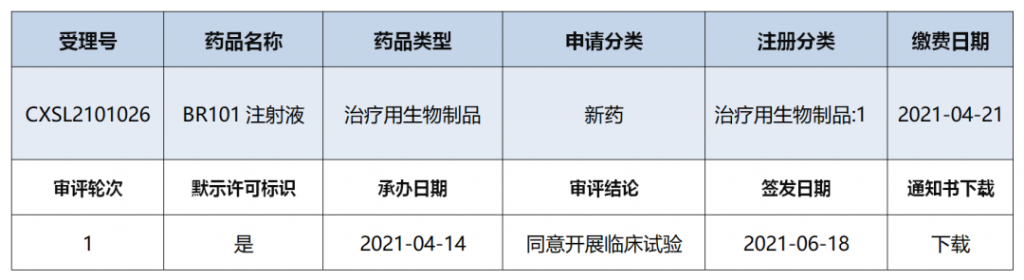
6月18日,浙江博锐生物制药有限公司(以下简称“博锐生物”)收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,批准博锐生物自主研发的1类新药BR101注射液开展用于晚期实体瘤临床试验。
BR101注射液为免疫检查点抑制剂,一种靶向CD73的全人源单克隆抗体,通过阻断腺苷的生成,解除免疫抑制。鉴于在肿瘤生长和转移中的关键作用,CD73已成为近年来肿瘤免疫疗法领域的热门靶点之一。对于实体瘤治疗而言,要提高免疫治疗的效果,解除肿瘤微环境(TME)对免疫效应细胞的抑制作用将起到重要作用,而CD73正是癌症中免疫抑制微环境形成的关键成分之一。
BR101可识别CD73独特表位,非竞争性阻断细胞膜和可溶性CD73的酶活性,降低肿瘤内腺苷生成,从而解除肿瘤微环境的免疫抑制。同时,BR101可显著降低CD73在细胞膜表面的表达,即非酶活性介导功能。目前很多肿瘤患者对PD-1/L1抑制剂无反应,还有部分患者在接受PD-1/L1抑制剂治疗后会产生耐药性。因此,BR101与其他免疫检查点类药物如抗PD-1/PD-L1单抗联用,可产生明显的肿瘤治疗协同作用,有望攻克大部分患者对PD-1/L1抑制剂无响应或者治疗后出现耐药性的难题。最新研究结果表明,在与PD-L1单抗等联用时,在胰腺癌、直肠癌及非小细胞肺癌治疗中具有明显的临床活性。
截至目前,全球范围内尚无靶向CD73的单克隆抗体药品上市。博锐生物一直深耕在自身免疫和肿瘤领域,BR101获批将加码博锐生物在抗癌领域布局,进一步聚焦优势领域拓宽产品管线。未来,博锐生物将继续积极探索个性化癌症治疗中的新型生物疗法,为全球患者带去更多优质优价的良药。

回到顶部