2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
发布日期:2023-08-01
浏览次数:49
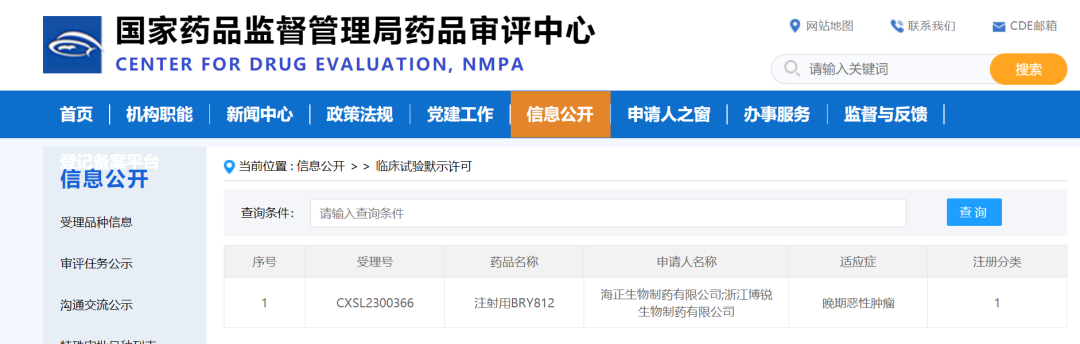
7月31日,浙江博锐生物制药有限公司(以下简称“博锐生物”)宣布其自主研发的1类创新型治疗用生物制品注射用BRY812临床试验申请获国家药品监督管理局批准,拟定适应症为晚期恶性肿瘤。注射用BRY812是靶向LIV-1的第三代抗体偶联药物,截至目前,全球尚未同靶点药物获批上市,博锐生物BRY812将成为全球第二个进入临床试验阶段的靶向LIV-1的药物。
LIV-1,又称SLC39A6或ZIP6,是一种多次跨膜蛋白,具有锌转运蛋白和金属蛋白酶活性。LIV-1直接参与细胞内锌离子的稳态代谢,可促进细胞外或细胞器内的锌离子转运到细胞质,在细胞生长中发挥作用。LIV-1还与上皮-间质细胞转化(EMT)有关,在多种癌症中表达异常,对肿瘤的转移起到关键作用。
注射用BRY812采用自主CysLink不可逆化学偶联技术平台,将靶向LIV-1的抗体与小分子毒素偶联获得。BRY812可识别肿瘤细胞表面过表达的LIV-1,并通过内吞作用进入肿瘤细胞释放小分子毒素杀伤肿瘤细胞。在临床前研究中,BRY812展现出了潜在的同类抗肿瘤活性;且相比其他同类药物具有更稳定的循环稳定性,能显著减少毒素的脱落和交换,具有良好的安全性及更优的治疗窗。此外,BRY812 能够诱导免疫原性细胞死亡(ICD),并增强 PD(L)-1 等免疫疗法的抗肿瘤作用。
博锐生物CEO王海彬博士表示:“近年来多款 ADC 药物获批上市,市场规模迅速增长。作为国内首款靶向LIV-1的ADC药物,博锐生物积极探索,在患者临床受益及创新靶点上布局。希望通过大家的努力,能够在肿瘤治疗领域取得越来越多的突破,为患者提供更多的治疗选择,同时延长患者的生命周期,改善患者的生存质量。”

回到顶部