2020 官网升级中!现在您访问官网的浏览器设备分辨率宽度低于1280px请使用高分辨率宽度访问。
发布日期:2021-05-28
浏览次数:79
近日,浙江博锐生物制药有限公司(以下简称“博锐生物”)宣布其自主研发的3款1类创新型生物制品BR101注射液、泽贝妥单抗注射液和BR102注射液临床试验申请先后获得国家药品监督管理局受理。
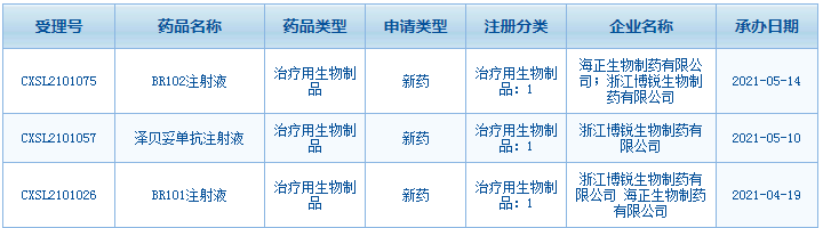
BR101注射液
BR101是一种靶向CD73的全人源单克隆抗体,CD73又称胞外-5′-核苷酸酶(Ecto-5′-Nucleotidase),是一种细胞表面酶,广泛表达于人体内皮细胞、淋巴细胞,如Treg等细胞表面。对临床肿瘤样本的分析显示,CD73在膀胱癌、乳腺癌、胰腺癌、黑色素瘤、神经胶质瘤、前列腺癌等多种恶性肿瘤细胞中的表达及活性显著升高。BR101可识别CD73独特表位,非竞争性阻断细胞膜和可溶性CD73的酶活性,降低肿瘤内腺苷的生成,从而解除肿瘤微环境的免疫抑制;同时,BR101可显著降低CD73在细胞膜表面的表达,即非酶活性介导功能。此外,抗PD-1/PD-L1单抗、放化疗等治疗方案可能引起肿瘤微环境CD73表达升高,继而通过腺苷信号抑制免疫反应,降低治疗效果,因此,BR101与其他免疫检查点类药物如抗PD-1/PD-L1单抗联用,亦可产生明显的肿瘤治疗协同作用。最新研究结果表明,在与PD-L1单抗等联用时,在胰腺癌、直肠癌及非小细胞肺癌治疗中具有明显的临床活性。
泽贝妥单抗注射液
泽贝妥单抗是一种主要针对B细胞表面CD20抗原的单克隆抗体,WHO国际非专利名称(INN)为Zuberitamab,与跨膜抗原CD20特异性地结合后,可启动B细胞溶解的免疫反应。由于抗CD20抗体对B细胞的特异性作用,被广泛应用于B细胞疾病的开发与治疗,包括B细胞淋巴瘤,均取得了较好的疗效;又因为其对外周血B细胞确切的清除效应,随后开始应用于自身免疫性疾病,如系统性红斑狼疮(SLE)、类风湿关节炎(RA)、AIHA、冷球蛋白病、获得性血友病甲、IgM多发性神经病、肾小球肾炎及治疗原发免疫性血小板减少症(ITP)等。泽贝妥单抗是博锐生物自主开发的新型差异化的全人源抗CD20单克隆抗体,目前已经开展非霍氏淋巴瘤的三期临床试验。本次申请为泽贝妥单抗新增适应症原发免疫性血小板减少症(ITP)的临床试验申请。
BR102注射液
BR102是一种同时靶向PD-L1和TGF-β的双功能融合蛋白,以我公司具有自主产权的抗PD-L1抗体为基础,其Fc末端以柔性linker连接融合突变型TGF-β II型受体胞外区(TGFβR2-ECD)。BR102注射液为联合免疫检查点抑制剂,通过抗PD-L1抗体和TGFβR2-ECD偶联同时阻断PD-L1和TGF-β信号通路,以达到解除免疫抑制,从多角度增强机体免疫系统对癌细胞的有效杀伤的目的。较PD-L1单抗药物而言,这种双功能蛋白理论上可以极大地发挥的药物治疗作用。
博锐生物总裁王海彬博士表示:“BR101注射液、泽贝妥单抗注射液和BR102注射液三个自主研发品种的临床试验申请获得受理,是博锐生物研发管线的重要里程碑,表明公司已从生物类似药研发转向创新型生物药研发,并开启了双特异性抗体领域的布局。博锐生物将继续致力于更多创新靶点药物的开发,为广大自身免疫性疾病和肿瘤患者提供更多优质、且可负担的治疗新选择。”

回到顶部